Юридическая компания «Пепеляев Групп» информирует о том, что 30 января 2024 г. принят Федеральный закон № 1-ФЗФедеральный закон от 30.01.2024 № 1-ФЗ «О внесении изменений в Федеральный закон «Об обращении лекарственных средств» и статьи 1 и 4 Федерального закона «О внесении изменений в Федеральный закон «Об обращении лекарственных средств» и Федеральный закон «О внесении изменений в Федеральный закон «Об обращении лекарственных средств».
, вносящий изменения в Закон № 61-ФЗ «Об обращении лекарственных средств»Федеральный закон от 12.04.2010 г. № 61-ФЗ «Об обращении лекарственных средств» (далее — Закон об обращении лекарственных средств, ФЗ-61).
. Изменения направлены на гармонизацию российского законодательства с едиными требованиями к обращению лекарственных препаратов в рамках ЕАЭС, а также на совершенствование существующего регулирования.
Закон вступает в силу с момента его опубликования – с 30 января 2024 г., за исключением отдельных положений, которые вступают в силу в три этапа: 1 сентября 2024 г., 1 января 2025 г. и 1 января 2026 г.
Как это было
Проект закона был внесен в Государственную Думу в августе 2023 г. и сразу же привлек внимание фармацевтической индустрии, так как предлагал ряд значимых изменений. В процессе рассмотрения законопроекта во II и III чтениях в него вносились правки с учетом различных рекомендаций и заключений. От некоторых первоначально предлагаемых изменений решено было отказаться.
Эксклюзивность данных
Одним из ключевых вопросов, затронутых законопроектом, являлся вопрос правового регулирования эксклюзивности данных клинических исследований. В финальной версии закона нормы об эксклюзивности данных были сохранены, но теперь они будут содержаться в ч. 51–53 ст. 13 Закона об обращении лекарственных средств.
Таким образом, сохранится существующее регулирование эксклюзивности данных, которое выглядит следующим образом:

Рекомендации
Изменение местоположения указанных норм о защите данных ДКИ и КИ в тексте закона, по нашему мнению, не решает сложившуюся на практике проблему противоречия применения норм национального законодательства и законодательства ЕАЭС, в котором отсутствуют аналогичные положения.
Практике уже известны споры на почве этого противоречияПостановление Арбитражного суда Московского округа от 26.09.2023 № Ф05-21974/2023. В настоящее время дело рассматривается в Судебной коллегии по экономическим спорам ВС РФ (см. карточку дела).: суды приходят к выводу, что отказ в регистрации воспроизведенного препарата до истечения четырех лет с момента регистрации референтного лекарства не может осуществляться, т. к. это противоречит нормам Решения ЕЭК № 78Решение Совета Евразийской экономической комиссии от 03.11.2016 № 78 «О Правилах регистрации и экспертизы лекарственных средств для медицинского применения».
.
Понятийный аппарат
Расширяется понятийный аппарат Закона об обращении лекарственных средств. Появилось новое определение высокотехнологичного лекарственного препарата, под которым теперь понимается генотерапевтический препарат или препарат на основе соматических клеток или тканеинженерный препарат.
Электронные государственные услуги
Государственные услуги, связанные с государственной регистрацией лекарственных препаратов для медицинского и ветеринарного применения, с 1 января 2025 г. будут предоставляться в электронной форме с использованием ФГИС «Единый портал государственных и муниципальных услуг (функций)».
Вместо бумажных бланков регистрационных удостоверений факт регистрации будет подтверждаться записью в реестре, а владельцу РУ по его запросу будет предоставляться выписка, заверенная соответствующим уполномоченным органом.
Ввод в оборот
Значительные изменения внесены в процедуру ввода лекарственных средств в гражданский оборот.
Теперь она будет действовать и в отношении фармацевтических субстанций.
Остальные изменения, по нашему мнению, направлены на сокращение объема регуляторных требований и снижение издержек на вывод лекарственных препаратов на рынок.
Основные изменения представлены на схеме.
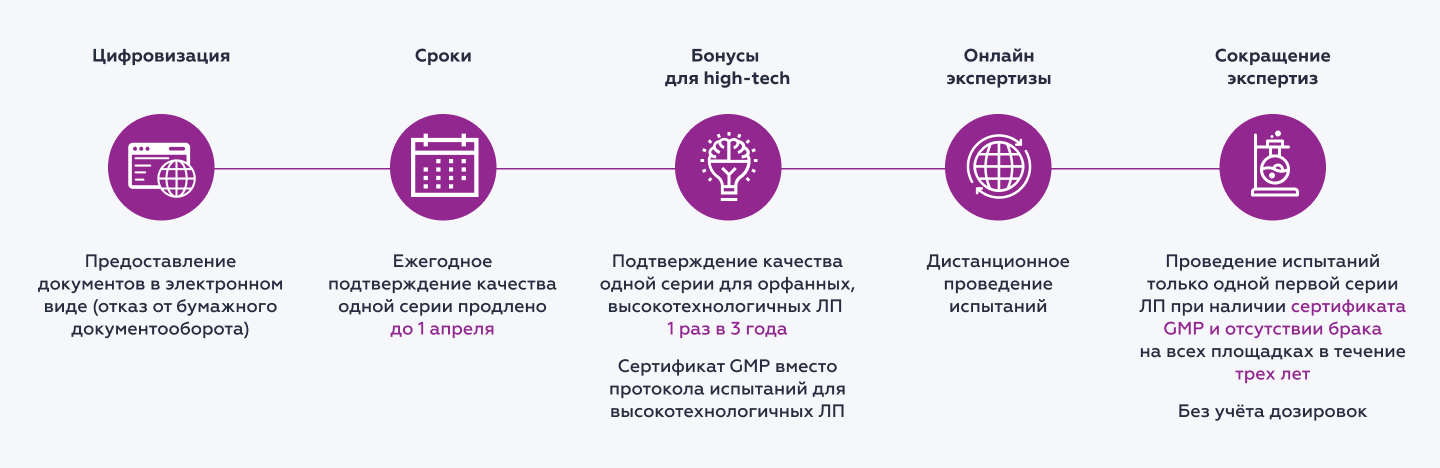
Теперь документы для получения разрешения на ввод лекарственных препаратов в оборот будут предоставляться в электронном виде. От бумажного документооборота решено полностью отказаться.
Продлеваются сроки ежегодного предоставления протоколов испытаний одной серии выпущенных на рынок лекарств. Такие протоколы необходимо будет предоставлять в Росздравнадзор до 1 апреля, а не до 1 февраля, как установлено действующими нормами.
Упрощен порядок ввода в оборот новых препаратов. Производитель (импортер) вправе предоставить протокол испытаний федеральной лаборатории только в отношении одной первой произведенной или ввозимой серии (партии) препарата при соблюдении двух дополнительных условий:
-
если вместе с ним предоставит сертификат GMP РФ или сертификат GMP ЕАЭС производственной площадки, где осуществлялось производство препарата;
-
если в течение предыдущих трех лет на всех производственных площадках этого производителя не было зафиксировано ни одного случая брака.
Особенности обращения орфанных, высокотехнологичных препаратов, в т.ч. для индивидуального применения
Определенных послаблений удалось добиться для производителей орфанных и высокотехнологичных препаратов, полученных из биологического материала определенного человека и предназначенных для применения в отношении этого же человека. Теперь для ввода в оборот первых серий таких препаратов нет необходимости предоставлять протокол испытаний о соответствии серии или партии препарата показателям качества в федеральной лаборатории.
Протокол испытаний первой серии (партии) высокотехнологичных препаратов для индивидуального применения может быть получен путем проведения дистанционных испытаний и предоставлен в Росздравнадзор в течение первых трех лет после вывода препарата на рынок (ч. 43 ст. 52.1 ФЗ-61). Подобный подход к проведению экспертиз уже был успешно опробован регулятором в 2022 году на фоне усиления санкционного давленияРуководство по соблюдению обязательных требований законодательства в сфере обращения лекарственных средств, касающихся особенностей ввода в гражданский оборот лекарственных препаратов для медицинского применения (разд. VII Постановления Правительства РФ от 05.04.2022 г. № 593) (утв. Федеральной службой по надзору в сфере здравоохранения 14.11.2022 г.).
.
Вместо ежегодного предоставления протокола испытаний высокотехнологичных препаратов их производители вправе предоставлять сертификат GMP РФ или сертификат GMP ЕАЭС производственной площадки, где осуществлялось его производство.
Процедура определения возможности рассматривать ЛП в качестве орфанного может проводиться как в отношении ЛП, уже зарегистрированного, так и в отношении незарегистрированного ЛП, а ГРЛС должен содержать информацию о том, является ли данный ЛП орфанным.
В государственный реестр лекарственных средств будет вносится информация о том, является ли тот или иной лекарственный препарат орфанным, иммунобиологическим, радиофармацевтическим, гомеопатическим, биологическим или высокотехнологичным лекарственным препаратом, впервые зарегистрированным в Российской Федерации по национальным или союзным правилам.
Кроме того, для производителей высокотехнологичных препаратов для индивидуального применения может быть исключена обязанность наносить средства идентификации на упаковку, если препарат производится малыми сериями, состоит из одной или нескольких доз и имеет короткий срок годности (до 90 календарных дней) или температурный режим хранения и транспортирования — 60 °С или ниже.
Отмена гос. регистрации и приостановление применения
С 1 января 2026 г. норма п. 8 ст. 32 ФЗ-61 об отмене государственной регистрации препарата в случае его отсутствия в обращении в РФ в течение трех и более лет перестает действовать в отношении препаратов для медицинского применения, но сохранит силу в отношении ветеринарных препаратов.
Рекомендации
Изначально предлагалось исключить процедуру приостановления регистрации в связи с отсутствием такой процедуры в праве Союза, но в финальной версии закона эту норму было решено оставить. Остается вопрос о том, каким образом этот механизм будет действовать, и подтвердят ли суды возможность его применения.
Лекарства в иностранной упаковке
С 1 сентября 2024 г. на постоянной основе будет разрешено ввозить оригинальные орфанные и высокотехнологичные препараты в течение 12 месяцев после даты их регистрации в иностранной упаковке (сейчас такой ввоз разрешен до конца 2024 года), однако данная норма не означает изменений в отношении действующих правил по параллельному импорту. Перечень условий для ввоза конкретной партии лекарств расширится целями разработки лекарственных средств и проведения научных и иных исследований.
О чем подумать, что сделать
Разработчикам и производителям лекарственных препаратов предстоит скорректировать внутренние процедуры подготовки регистрационных досье и комплектов документов на внесение изменений в них с учетом предстоящего перехода на электронный формат подачи документов в регистрирующий орган.
Производителям орфанных и высокотехнологичных препаратов можно рекомендовать провести аудит бизнес-процессов и усилить контроль за качеством производства, чтобы воспользоваться преференциями в части ввода в гражданский оборот.



