ПРИНЯТЫЕ АКТЫ
Срок национальной регистрации медизделий продлен до 31 декабря 2025 года
Государственная Дума приняла Законопроект №
396469-8 «О ратификации Протокола о внесении изменения в Соглашение о единых принципах и правилах обращения медицинских изделий (изделий медицинского назначения и медицинской техники) в рамках Евразийского экономического союза от 23 декабря 2014 года»принят 20.07.2023 г.
.
Протокол предусматривает продление национальной процедуры регистрации медицинских изделий в Евразийском экономическом союзе до 31 декабря 2025 года. В соответствии со ст. 23 Федерального закона от 15.07.1995 г. №101-ФЗ "О международных договорах Российской Федерации" и согласно ст. 2 самого Протокола он временно применяется с даты подписания.
С 01.01.2023 медицинские изделия могли быть зарегистрированы только в соответствии с законодательством Союза. С 13.02.2023 г. возобновилась национальная регистрация медизделий, которая продлится 1 января 2026 г., когда предусмотрен окончательный переход на союзные правила регулирования обращения медизделий.
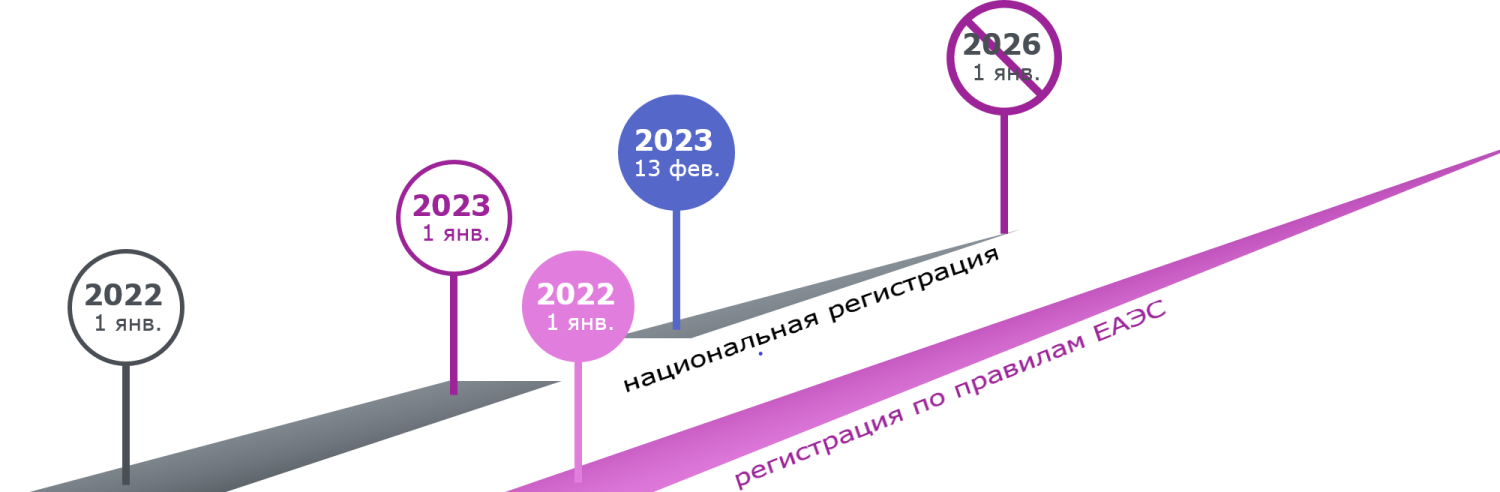
Важно учитывать, что медзизделия, зарегистрированные по национальным нормам одного из государств ЕАЭС, могут выпускаться в обращение на территории этого государства до окончания срока действия национальных регистрационных удостоверений.
Обязательная маркировка ряда медицинских изделий с 1 октября 2023 года
Вступило в силу Постановление Правительства Российской Федерации от 31.05.2023 №894 «Об утверждении Правил маркировки отдельных видов медицинских изделий средствами идентификации…».
К перечню медицинских изделий, подлежащих маркировке, относятся в том числе:
-
Обеззараживатели ― очистители воздуха;
-
Обувь ортопедическая и корригирующих стельки, полустельки;
-
Слуховые аппараты;
-
Стенты коронарные;
-
Компьютерные томографы;
-
Прокладки и подгузники для взрослых.
1 сентября 2023 года - переход на обязательную маркировку отдельных видов медицинских изделий. С указанной даты производители, импортеры и продавцы указанной продукции должны подавать заявления на регистрацию в государственной системе мониторинга.
В течение 15 календарных дней со дня указанной регистрации необходимо обеспечить готовность собственных программно-аппаратных средств к информационному взаимодействию с системой мониторинга и направить в ЦРПТ электронную заявку на прохождение тестирования. На само тестирование также отводится 15 календарных дней.

Подробнее про маркировку можно прочесть в нашем алерте.
Как получить разрешение на вывоз из РФ отдельных видов медицинских товаров?
9 марта 2022 года Правительство РФ определило перечень товаров и оборудования, запрещенных к вывозу из страны до конца года. В него попало более 200 наименований, в том числе фармацевтическая продукция. Позднее список был расширен, а Росздравнадзор утвердил порядок выдачи разрешений на вывоз медизделий. В конце октября 2022 года запрет на вывоз из страны был продлен Президентом РФ до 31 декабря 2023 года.
Для получения разрешения на вывоз необходимо руководствоваться Приказом Росздравнадзора от 02.05.2023 № 2744 «Об утверждении Порядка выдачи разрешений на вывоз за пределы территории Российской Федерации отдельных видов товаров медицинского назначения …», который вступил в силу 11 июля 2023 года.
В Приказе указано, что заявитель (юридическое лицо/индивидуальный предприниматель) должен направить в Росздравнадзор заявление на бумаге (и приложить информацию на электронном носителе) либо через информсистему ведомства. Разрешение выдают отдельно на каждую партию в рамках одного договора поставки.
Помимо этого, Приказом были установлены порядок подачи заявления, требования к его содержанию и прилагаемым документам, сроки рассмотрения заявления, основания для отказа в выдаче разрешения.
|
Порядок подачи заявления |
Требование к содержанию |
Сроки рассмотрения |
Основания для отказа |
|
|
|
|
|
Приказ будет действовать до 31 декабря 2023 года. Продление/отмена этого ограничения будет зависеть от дальнейшего решения со стороны Правительства РФ.
Росздравнадзор утвердил регламент допуска неоригинальных запчастей к сервису медтехники
1 сентября 2023 года вступит в силу Приказ Федеральной службы по надзору в сфере здравоохранения от 16.05.2023 № 2983 «Об утверждении перечня представляемых документов и требований к их содержанию, формы заключения о возможности (невозможности) использования комплектующих или принадлежностей медицинского изделия, не предусмотренных в их технической и (или) эксплуатационной документации производителя (изготовителя)...».
Для целей допуска комплектующих медицинских изделий при установлении дефектуры/рисков ее возникновения ( постановление Правительства РФ от 1 апреля 2022 г. № 552), утверждены следующие документы:
- Перечень документов, представляемых для получения заключения о возможности/невозможности использования комплектующих/аксессуаров медицинского изделия, если такие комплектующие/аксессуары не предусмотрены технической/эксплуатационной документацией производителя/изготовителя, и требования к их содержанию:
|
Обязательные документы |
Факультативные документы |
|
|
|
- Форма заключения о возможности (невозможности) использования комплектующих или принадлежностей медицинского изделия, не предусмотренных в их технической и (или) эксплуатационной документации производителя (изготовителя).
Перечень сведений о таких компонентах/аксессуарах медицинского изделия, который будет размещен на сайте ФГБУ «Всероссийский научно-исследовательский и испытательный институт медицинской техники».
Регламент будет действовать с 1 сентября 2023 года, причем срок его действия ограничен дедлайном национальной процедуры регистрации медицинских изделий, который установлен на 31.12.2025 г.




